研究进展 | 益生元、益生菌与肠道菌群及肠道健康
本文系Food Science and Human Wellness原创编译,欢迎分享,转载请授权。
益生菌摄入改变肠道微生物组的稳定性,而连续补充低聚半乳糖可改善肠道微生物组的稳定性
稳定的肠道微生物组在维持宿主健康方面起着关键作用,而肠道微生物组的不稳定性也被发现是各种代谢性疾病的危险因素。在生态和进化尺度上,摄入的益生菌和本土肠道微生物组之间不可避免的竞争会导致不稳定性的增加。外源性益生元是否以及如何改善整体肠道微生物组的稳定性,在很大程度上仍不清楚。海南大学的Chenchen Ma、Jiachao Zhang,中国科学院青岛生物能源与过程研究所的Zheng Sun,内蒙古农业大学的Zhihong Sun等,在本研究中以植物乳杆菌HNU082(Lp082)为模型益生菌,利用枪式宏基因组测序,研究连续或脉冲式补充低聚半乳糖(GOS)对小鼠肠道微生物组稳定性的影响。
在竞争条件下,只有持续补充GOS能促进益生菌的生长,降低其单核苷酸多态性(SNPs)突变。此外,持续补充GOS增加了益生菌的整体稳定性,重塑了益生菌与原生微生物组中拟杆菌属的竞争性相互作用,相应地,碳水化合物活性酶(CAZymes)的过量也很明显。同时,研究还发现在原生微生物组中,共有793个SNPs在益生菌管理中产生。其中超过90%的SNP来自于拟杆菌属,涉及编码转座酶、CAZymes和膜蛋白的基因。然而,2 种GOS补充均没有在益生菌摄入过程中缓和原生微生物内的整体适应性突变。综上所述,本研究证明了持续补充益生元对肠道微生物组的生态和遗传稳定性的有益影响。
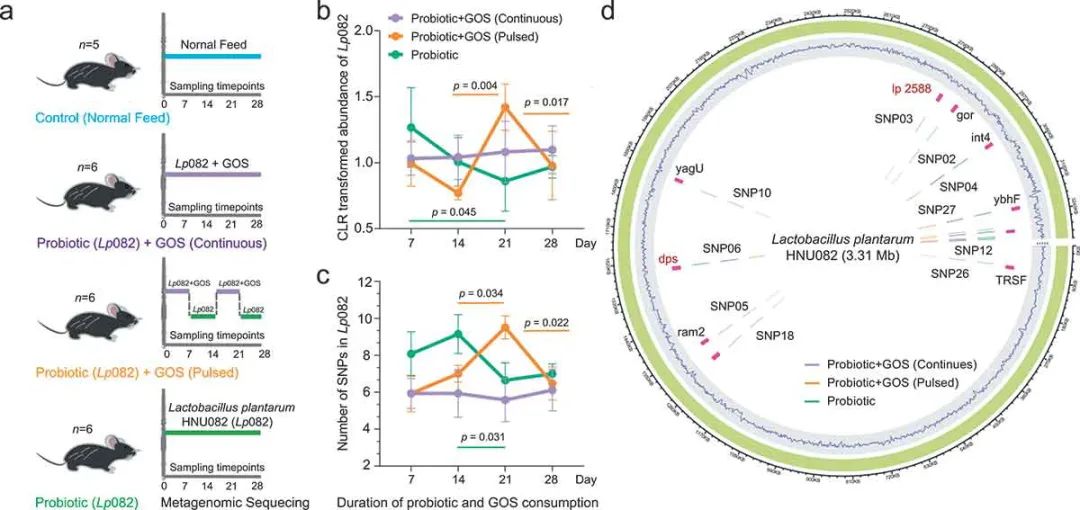
图1 实验设计与Lp082在宿主肠道内的适应性进化
持续补充GOS稳定了益生菌入侵引起的肠道原生微生物群的结构波动
为阐明原生肠道微生物组对摄入益生菌的反应是否依赖于GOS补充剂,基于物种级分类图谱的布雷-柯蒂斯距离,对原生肠道微生物组的β多样性的时间变化进行了量化(图2a)。
益生菌的摄入自发地导致粪便α多样性的增加(图2c),并引起原生微生物群落结构随时间的剧烈扰动(图2b,2c)。与此相反,在持续补充GOS之后,在GOS+益生菌(GPC)组中观察到肠道微生物群落随时间的相对高稳定性(图2b,2c)。脉冲式GOS补充增加了益生菌衍生的波动。这一结果表明,只有持续补充益生元才能减少这种因益生菌入侵而导致的微生物组不稳定性。在所有益生菌处理组中,GPC组的物种级类群数量最少,随着时间的推移,其丰度与对照组趋于差异(图2d)。
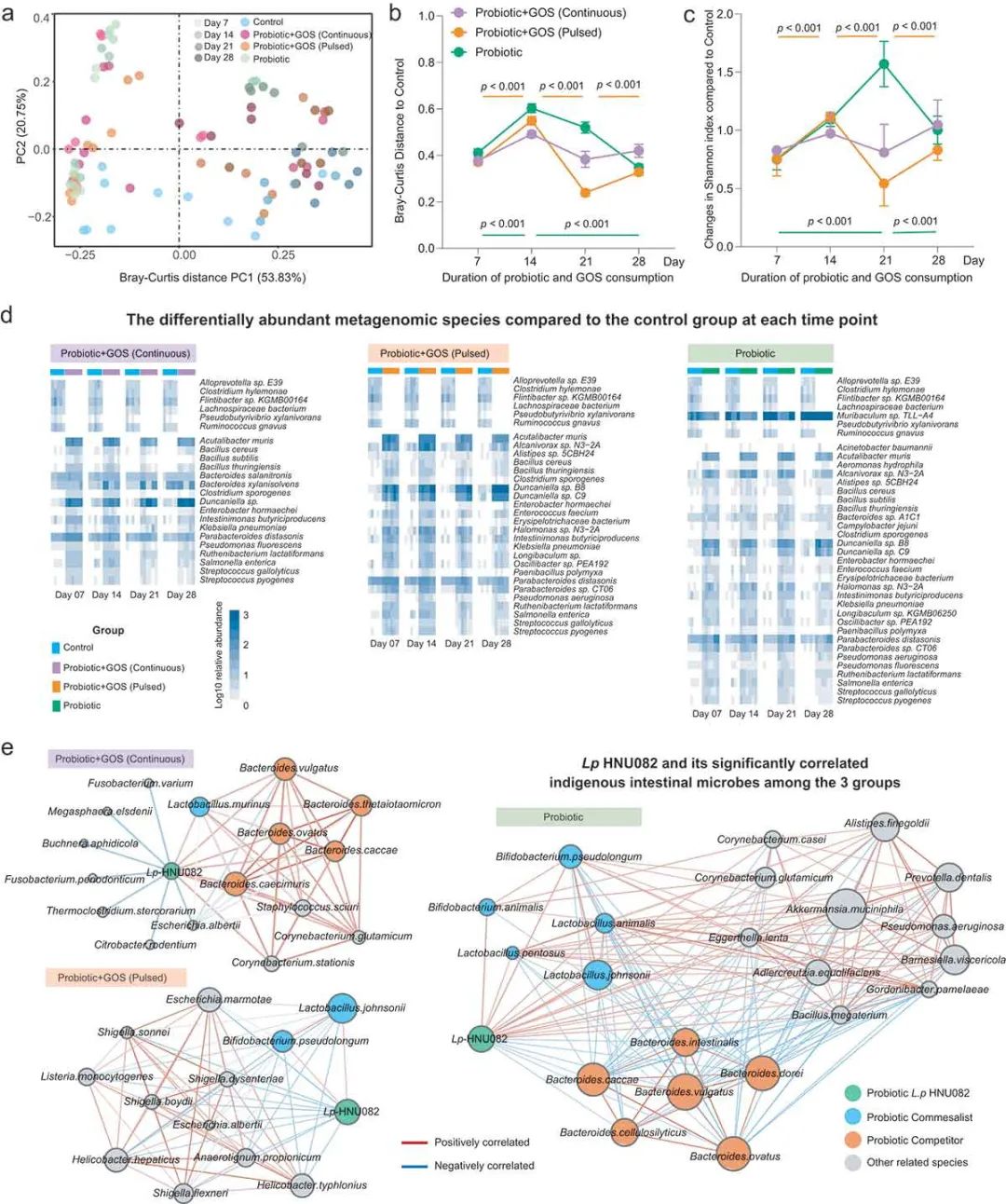
图2 原生肠道微生物组在分类学水平上对益生菌摄入的反应
Reference:
MA C C, WASTI S, HUANG S, et al. The gut microbiome stability is altered by probiotic ingestion and improved by the continuous supplementation of galactooligosaccharide[J]. Gut Microbes, 2020, 12. DOI:10.1080/19490976.2020.1785252.
丁酸梭菌(一种产生丁酸盐的益生菌)通过调节Wnt信号和肠道微生物群抑制肠道肿瘤的发展
肠道微生物群失调与肠道致癌密切相关。在结直肠癌(CRC)患者中观察到产丁酸盐菌明显减少,尽管如此,产丁酸盐菌对肠道肿瘤发展的潜在益处尚未得到充分研究。天津医科大学的Danfeng Chen、Bangmao Wang、Hailong Cao等研究发现,丁酸梭菌(Clostridium butyricum,临床上常用的丁酸盐生产菌之一)能显著抑制Apcmin/+小鼠中高脂饮食(HFD)诱导的肠道肿瘤发展。此外,用丁酸梭菌处理的肠道肿瘤细胞表现出增殖减少和凋亡增加。丁酸梭菌抑制了Wnt/β-连环蛋白信号通路,并调节了肠道微生物群的组成,表现为一些致病菌和胆汁酸(BA)生物转化菌的减少,以及一些有益菌的增加,包括短链脂肪酸(SCFA)生产菌。相应地,丁酸梭菌降低了粪便次生BA的含量,增加了盲肠SCFA的数量,并激活了G-蛋白偶联受体(GPRs),如GPR43和GPR109A。利用小干扰RNA(siRNA)对GPR43进行基因沉默,可钝化丁酸梭菌的抗增生作用。通过对临床标本的分析发现,从人体正常结肠组织到腺瘤再到癌症,GPR43和GPR109A的表达量逐渐下降。本研究结果表明,丁酸梭菌可以通过调节Wnt信号和肠道微生物群来抑制肠道肿瘤的发展,从而提示丁酸梭菌对CRC的潜在功效。
丁酸梭菌抑制肠道肿瘤细胞增殖并刺激其凋亡
在20%的浓度下,与对照组相比,丁酸梭菌上清液以时间依赖性的方式显著降低了HCT116细胞的活力(P<0.001;图3A);然而,在相对较低的浓度下,即10%,丁酸梭菌上清液对细胞活力几乎没有影响。用Caco-2细胞进行的实验显示,浓度为20%的丁酸梭菌上清液降低了48 h和72 h的细胞活力(P<0.001;图3A)。作为阳性对照的丁酸钠,浓度依赖性(0、0.1、1 mmol/L和10 mmol/L)地降低了CRC细胞的活力,但对时间的依赖性不明确。
分别用Ki-67免疫组化和TUNEL定量检测小鼠肠肿瘤细胞的增殖和凋亡情况。与HFD-PBS组相比,丁酸梭菌处理组结肠肿瘤内Ki-67阳性率显著降低(20.84±3.50 vs. 38.38±4.25,P<0.01;图3B),凋亡细胞比例增加(7.99±0.24 vs. 1.81±0.12,P<0.001;图3C)。这些结果表明,丁酸梭菌能显著抑制肠道肿瘤细胞的增殖,并刺激其凋亡。
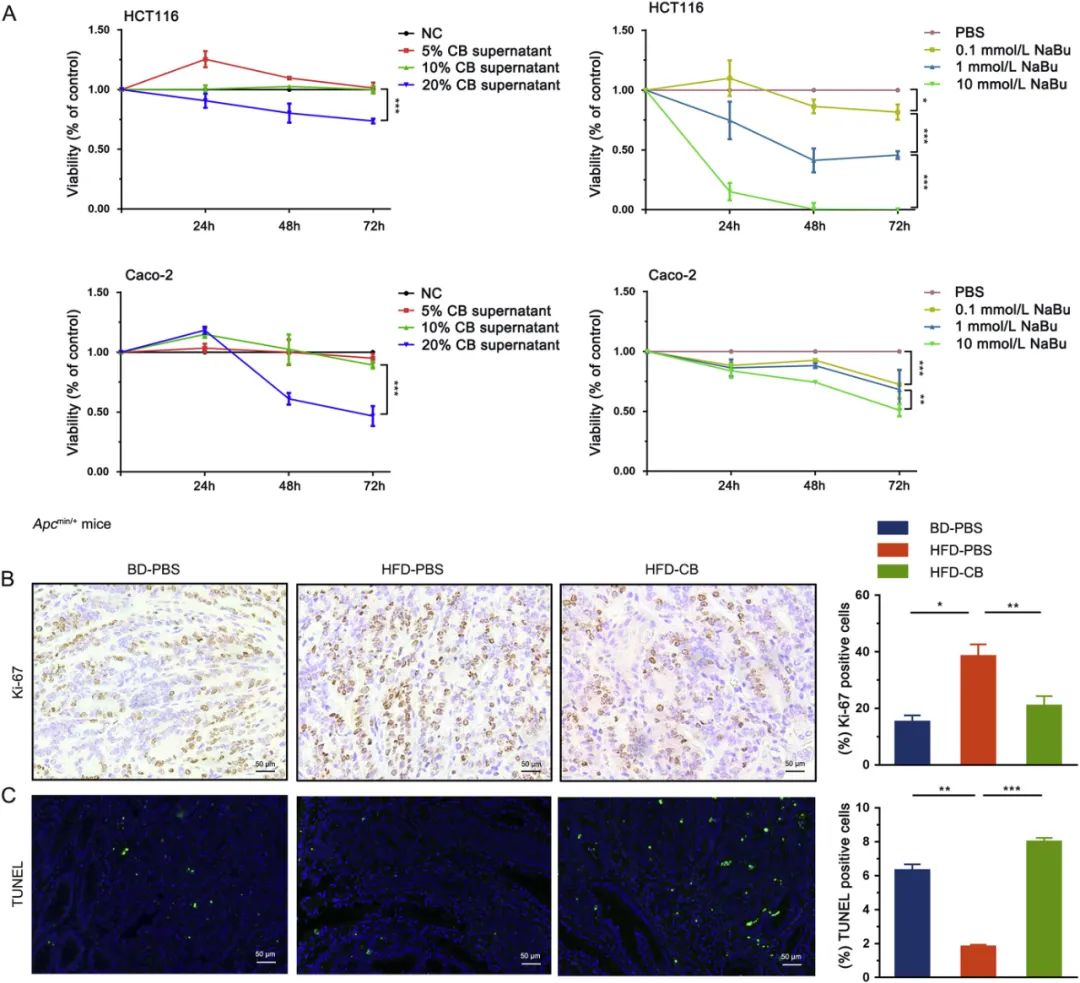
图3 丁酸梭菌抑制肠道肿瘤细胞的增殖并促进其凋亡
Reference:
CHEN D F, JIN D C, HUANG S M, et al. Clostridium butyricum, a butyrate-producing probiotic, inhibits intestinal tumor development through modulating Wnt signaling and gut microbiota[J]. Cancer Letters, 2020, 469: 456-467. DOI:10.1016/j.canlet.2019.11.019.
益生菌、益生元和合生元可差异地调节肠道菌群并恢复特定肠道微生物的相对丰度
发酵乳是益生菌的有效载体,食用益生菌可改善宿主健康。益生菌、益生元和合生元对肠道菌群失调的有益作用此前已有报道。然而,特定的益生菌、益生元和合生元调节肠道微生物的方式仍不清楚。因此,河北大学的Chen Li、Zhihua Niu、Meijuan Zou、Hongtao Tian和夏威夷大学马诺阿分校的Rajesh Jha等,在本研究中将益生菌鼠李糖乳杆菌AS 1.2466、德氏乳杆菌保加利亚亚种ATCC 11842,以及益生菌低聚木糖和红参提取物喂给小鼠,以确定它们对肠道微生物群的影响。然后,给小鼠灌胃注射低聚木糖和鼠李糖乳杆菌(合成),测定不同时间肠道内鼠李糖乳杆菌的数量。
结果表明,益生菌和益生元能迅速降低厚壁菌门/拟杆菌门的比例(F/B),抑制有害菌(如克雷伯菌和大肠杆菌),加速肠道有益微生物(如乳酸菌)的恢复。在复杂的肠道微生态中,不同的益生菌和益生元对特定的肠道微生物有不同的作用,短期内无法恢复。此外,以0.12 g/kg添加胃内低聚木糖20 d后,小鼠回肠内鼠李糖乳杆菌的定植量为7.48 log CFU/mL,高于低剂量组,延长了定植时间,增加了肠道内益生菌的数量。因此,本研究表明,益生菌和益生元可以通过调节肠道内的特定微生物来促进肠道微生物菌群的平衡,适当组合合生元的效果是有益的,为开发富含合生元的新型乳制品奠定了基础。
益生菌对肠道微生物群的影响
通过口服含有乳酸菌的产品,如酸奶和益生菌制剂,可以迅速改变宿主肠道微生物群的结构。为确定口服益生菌对小鼠肠道痢疾的影响,进行了菌种组成关系分析。门水平分析显示,主要微生物为软壁菌门、放线菌门、蓝细菌、疣微菌门、变形菌门、厚壁菌门和拟杆菌门。通过灌胃法去除保加利亚乳杆菌和鼠李糖乳杆菌,发现与CON7(对照组7 d)相比,NR7(恢复组7 d)组的F/B迅速下降,而LB7(保加利亚乳杆菌组7 d)和LR7(鼠李糖乳杆菌组7 d)组的F/B明显恢复(图4A)。
进一步分析各菌种在属水平上的组成,发现各组微生物多样性丰富,部分特有菌在各组间存在差异(图4B,4C)。NR7组中典型的有害菌—克雷伯氏菌和大肠杆菌的相对丰度明显高于其他组,但有益菌(乳酸菌)的丰度较低(P<0.001)。益生菌干预后(与NR7组相比),不仅传统有益菌—乳酸菌在LB7组和LA7组中显著恢复(P<0.01),而且最近发现的有益菌Akkermansia、Blautia和Ruminaceae也显著恢复。同时,LB7和LA7组中有害菌的丰度也极低。这说明益生菌可以迅速恢复胃肠道中有益菌的丰度,抑制有害菌,帮助恢复抗生素造成的肠道微生物群失衡。
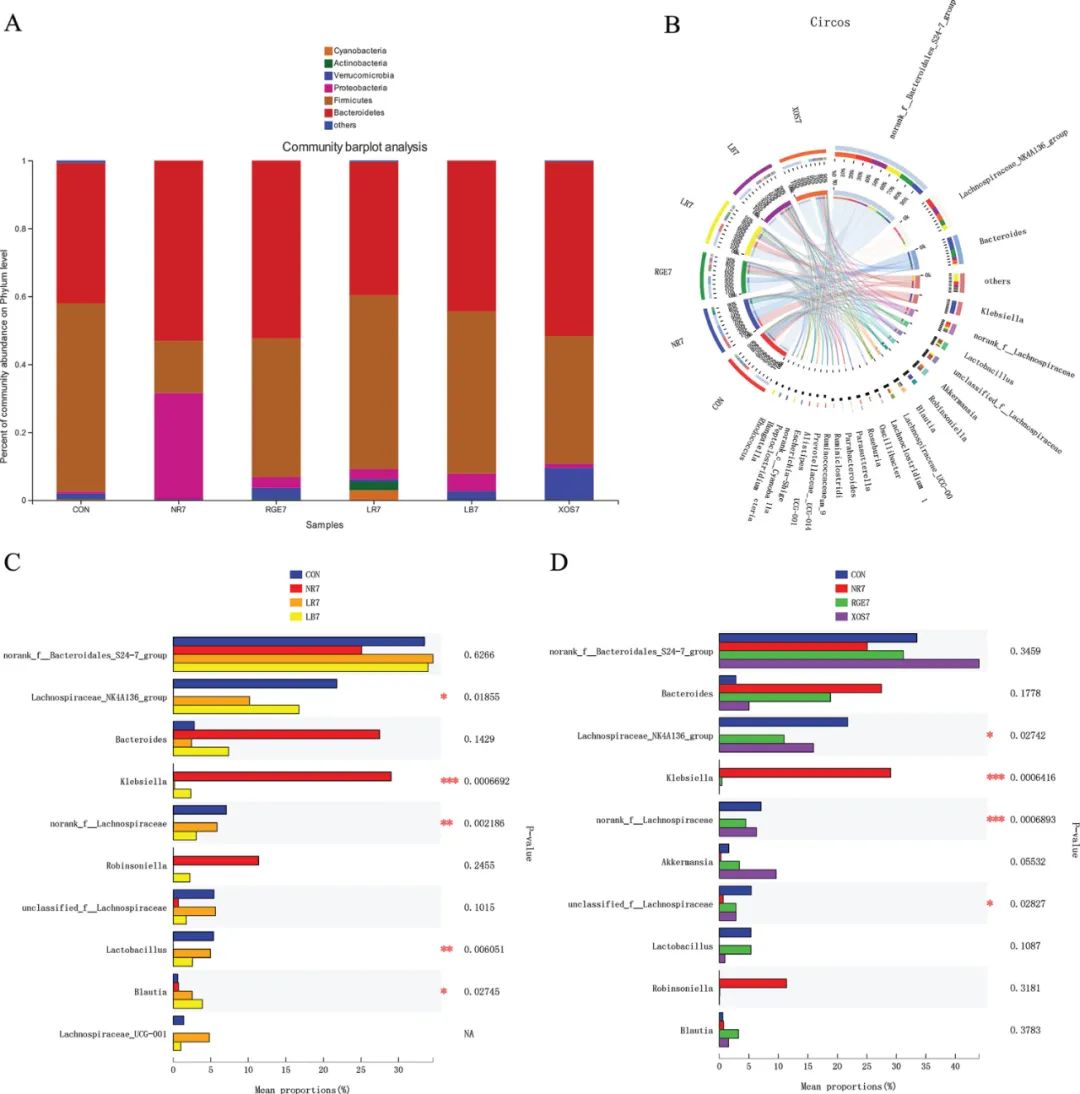
图4 乳杆菌调节小鼠肠道菌群的结构变化
益生元对肠道微生物群的影响
低聚木糖是一种新兴的益生菌,红参提取物是一种天然植物产品,已被公认为一种新型益生元。给予益生元后,通过对肠道微生物群的分析,发现XOS7(低聚木糖组7 d)和RGE7(红参提取物组7 d)组的F/B得到恢复。两组中乳酸菌、Akkermansia、Blautia和Ruminaceae等有益菌的丰度高于NR7组,但差异无统计学意义。两组中克雷伯氏菌、大肠杆菌等有害菌的丰度均极低。与益生菌干预相比,NR7组中毛螺旋菌科的丰富度明显低于CON、RGE7和XOS7组(P<0.01)。这说明益生菌和益生元对肠道微生物生态的调控方式相似,但益生菌和新兴益生元对肠道微生物的影响更趋于差异化。
Reference:
LI C, NIU Z H, ZOU M J, et al. Probiotics, prebiotics, and synbiotics regulate the intestinal microbiota differentially and restore the relative abundance of specific gut microorganisms[J]. Journal of Dairy Science, 2020, 103: 5816-5829. DOI:10.3168/jds.2019-18003.
腹腔疾病中的肠道菌群与益生菌
腹腔疾病(Celiac disease,CeD)是一种免疫介导的肠病,其独特之处在于已知的特异性诱因:麸质。目前治疗的主要方法是无麸质饮食(gluten-free diet,GFD)。随着新型疗法的开发,辅助性策略也在研究中,如肠道微生物群的调控。肠道微生物群参与了几种慢性疾病中肠道炎症的发生和延续。据报道,与健康受试者相比,CeD患者(未经治疗或接受GFD治疗)的肠道生物失调。一些研究已经确定了与CeD患者和健康受试者相关的不同细菌种群。然而,目前仍不清楚肠道菌群失调是CeD的病因还是影响结果。益生菌也被认为是将肠道微生物群调节为抗炎状态的一种策略。然而,支持其用于治疗CeD的数据还很缺乏。需要进一步的研究,将治疗性微生物配方与人体试验相结合,研究如何利用益生菌治疗CeD,使肠道微生物群恢复到抗炎状态。本综述作者为加拿大阿尔伯塔大学的Richa Chibbar和Levinus A. Dieleman。
益生菌可以通过3 种潜在机制影响CeD。第一种是将麸质蛋白消化成非免疫性的小多肽,消除和/或减少诱发CeD的因素,从而防止CeD的发生;第二种是通过防止免疫性多肽进入固有层来维持肠道屏障;第三种是利用益生菌在肠道微生物组的平衡和调节先天性和适应性免疫系统中的作用。
虽然肠道微生物群/菌群失调的改变与CeD的发展有关,但其在发病中的确切功能仍不清楚。有限的人体研究显示益生菌作为一种治疗方式对CeD有积极的作用,但还需要更多的研究来专门调控肠道微生物群以改变病程。迄今,益生菌无法对肠道微生物群进行持久的改造,十二指肠菌群失调现象持续存在。此外,人们还对益生菌的安全性表示担忧,包括已有记载的细菌、缺乏监管以及缺乏与宿主微生物群相互作用的知识。益生菌在CeD中似乎有调节肠道微生物群的作用,然而,需要进一步的随机研究,特别是人体研究,以更好地了解其在治疗CeD中的作用。基本了解益生菌影响CeD的生化/分子机制,将有助于精确地制定有益微生物的类型和浓度,从而开发出安全的治疗方式,改变CeD的病程。
Reference:
CHIBBAR R, DIELEMAN L A. The gut microbiota in celiac disease and probiotics[J]. Nutrients, 2019, 11(10): 2375. DOI:10.3390/nu11102375.

